Estrutura de Hidróxido de Cromo, Propriedades e Usos
O hidróxido de cromo é um produto composto inorgânico da reação de uma base com um sal de cromo. A sua fórmula química varia com o estado de oxidação do crómio (2 ou 3, para este tipo de composto). Tendo assim Cr (OH)2 para o hidróxido de cromo (II) e Cr (OH)3 para o hidróxido de cromo (III).
Por razões eletrônicas, o Cr2+ é mais instável que Cr3+, então o Cr (OH)2 é um agente redutor (perde um elétron para passar a +3). Assim, embora ambos os hidróxidos possam ser obtidos como precipitados, Cr (OH)3 - também chamado de hidróxido crômico - é o composto predominante.

Ao contrário daqueles hidróxidos obtidos pela simples dissolução de óxidos metálicos em água, Cr (OH)3 não é sintetizado por esta via devido à baixa solubilidade do óxido crômico (Cr2O3, imagem superior). No entanto, Cr (OH)3 Considera-se como o Cr2O3· XH2Ou, usado como um pigmento verde esmeralda (verde Guinet).
Na parte laboratorial do cromo metálico, que é dissolvido em solução ácida para a formação do complexo [Cr (OH2)6]3+. Este complexo aquoso reage então com uma base (NaOH ou KOH) para formar o correspondente hidróxido crómico.
Se as etapas anteriores forem realizadas sob condições que garantam a ausência de oxigênio, a reação origina Cr (OH)2 (hidróxido de cromo). Subsequentemente, é necessária uma separação e desidratação do sólido precipitado. Como resultado, "true" (OH) é "nascido"3, um pó verde com uma estrutura polimérica e incerto.
Índice
- 1 estrutura
- 1.1 O octaedro e a polimerização
- 2 propriedades físicas e químicas
- 2.1 Anfotericismo
- 3 Síntese de hidróxido de cromo no campo industrial
- 4 usos
- 5 referências
Estrutura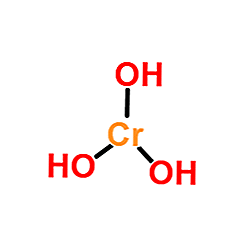
A imagem superior é a representação mais simples de Cr (OH)3 em fase gasosa e isolada. Da mesma forma, e assumindo o caráter puramente iônico de suas interações, as crações sólidas podem ser visualizadas3+ interagindo com uma quantidade triplicada de aniões OH-.
No entanto, a natureza da ligação Cr-OH é mais covalente, devido à química de coordenação do Cr3+.
Por exemplo, o complexo [Cr (OH2)6]3+ indica que o centro metálico do cromo é coordenado com seis moléculas de água; Como estes são neutros, o complexo exibe a carga positiva do cátion original, Cr3+.
O octaedro e polimerização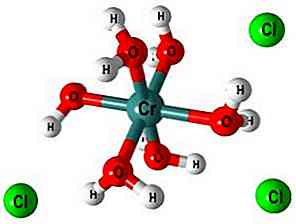
Na imagem superior, a estrutura do complexo [Cr (OH2)6]3+. Íons Cl- eles podem vir, por exemplo, do ácido clorídrico, se ele tiver sido usado para a dissolução de sal ou óxido crômico.
Quando NaOH (ou KOH) é adicionado ao meio de reação, o íon OH- desprotona uma molécula deste complexo, formando [Cr (OH2)5(OH)]2+ (Agora existem cinco moléculas de água porque o sexto perdeu um próton).
Consecutivamente, este novo complexo desidrata outro complexo aquoso, criando dímeros ligados por pontes de hidróxido:
(H2O)5Cr-OH-Cr (OH2)5
À medida que a basicidade do meio aumenta (o pH aumenta), o complexo é formado [Cr (OH2)4(OH)2]+e também aumenta a probabilidade de novas pontes de hidróxido para criar polímeros gelatinosos. Na verdade, essa "geléia cinza-esverdeada" se recusa a entrar em ordem.
Finalmente, o Cr (OH2)3(OH)3 consiste de um octaedro com o Cr3+ no centro, e ligado a três moléculas de água e três OH- que neutralizam sua carga positiva; isso sem considerar a polimerização.
Quando o Cr (OH2)3(OH)3 desidrata, a água coordenada com o Cr é eliminada3+e como esse cátion é coordenado com seis espécies (ligantes), surgem estruturas poliméricas nas quais as ligações Cr-Cr podem estar envolvidas.
Além disso, quando desidratado, sua estrutura pode ser considerada tipo Cr2O3· 3H2O; em outras palavras, o óxido crômico tri-hidratado. No entanto, são os estudos físico-químicos do sólido que podem esclarecer a verdadeira estrutura do Cr (OH)3 neste ponto.
Propriedades físicas e químicas
O Cr (OH)3 Tem a aparência de um pó azul-esverdeado, mas quando entra em contato com a água forma um precipitado cinza-esverdeado gelatinoso.
É insolúvel em água, mas solúvel em ácidos e bases fortes. Além disso, quando aquecido, se decompõe, produzindo vapores de óxido de cromo.
Anfoterismo
Por que o hidróxido de cromo é solúvel em soluções ácidas e básicas? A razão é devido à sua natureza anfotérica, que permite reagir com ácidos e bases. Esta propriedade é característica do Cr3+.
Ao reagir com ácidos, Cr (OH2)3(OH)3 dissolve-se porque as pontes de hidroxila se quebram, responsáveis pela aparência gelatinosa do precipitado.
Por outro lado, quando mais base é adicionada, o OH- eles continuam substituindo as moléculas de água, formando o complexo negativo [Cr (OH2)2(OH)4]-. Este complexo torna a solução uma cor verde clara, que se intensifica à medida que a reação avança.
Quando todo o Cr (OH2)3(OH)3 Uma vez que tenha reagido, um complexo final é obtido como indicado pela equação química:
Cr (OH2)3(OH)3 + 3 OH- <=> [Cr (OH)6] 3- + 3 H2O
Este complexo negativo está associado aos cátions ao redor (Na+, se a base é NaOH), e após a evaporação da água, o sal de cromita de sódio precipita (NaCrO2, verde esmeralda). Assim, tanto o meio ácido como o básico são capazes de dissolver o hidróxido de crómio.
Síntese de hidróxido de cromo no campo industrial
Na indústria, é produzido pela precipitação de sulfato de cromo com soluções de hidróxido de sódio ou hidróxido de amônio. Da mesma forma, o hidróxido de cromo é produzido pela reação esquematizada:
CrO72- + 3 SO2 + 2H+ => 2 Cr3+ + 3 SO42- + H2O
Cr3+ + 3OH- => Cr (OH)3
Como mostrado no procedimento anterior, a redução do cromo VI para o cromo III tem grande importância ecológica.
O cromo III é relativamente inócuo para a biota, enquanto o cromo VI é tóxico e carcinogênico, além de muito solúvel, por isso é importante eliminá-lo do meio ambiente.
A tecnologia de tratamento de águas residuais e solo inclui uma redução de Cr (VI) para Cr (III).
Usos
- Formulação de maquiagens.
- Agentes corantes para cabelos.
- tintas para unhas.
- Produtos para cuidados com a pele.
- Produtos de limpeza.
- No acabamento de metais, o que representa 73% do seu consumo na indústria.
- Na preservação da madeira.
Referências
- Whitten, Davis, Peck & Stanley. Química (8a ed.). CENGAGE Learning, p 873, 874.
- PubChem. (2018) Hidróxido Crômico. Retirado em 18 de abril de 2018, de: pubchem.ncbi.nlm.nih.gov
- N4TR! (22 de junho de 2015). Hidróxido de cromo (III). [Figura] Retirado em 18 de abril de 2018, de: commons.wikimedia.org
- Martínez Troya, D., Martín-Pérez, J.J. Estudo para o uso experimental de óxidos de cromo e hidróxidos nas classes médias. BORAX nº 2 (1) - Revisão de Química Prática para o Secundário e o Bachillerato-IES. Zaframagón-ISSN 2529-9581.
- Síntese, caracterização e estabilidade de hidróxidos de Cr (III) e Fe (III). (2014) Papassiopi, N., Vaxevanidou, K., Christou, C., Karagianni, E. e Antipas, G. J. Hazard Mater. 264: 490-497.
- PrebChem. (9 de fevereiro de 2016). Preparação de hidróxido de cromo (III). Retirado em 18 de abril de 2018, de: prepchem.com
- Wikipédia. (2018) Hidróxido de cromo (III). Retirado em 18 de abril de 2018, de: en.wikipedia.org




