Fórmula, propriedades, riscos e usos do óxido de plumbato (PbO)
O óxido gordo, também conhecido como óxido de chumbo (II) ou monóxido de chumbo, é um composto químico de fórmula PbO. É encontrado em dois polimorfos: o litharge e o masicotite. Sua estrutura é ilustrada na figura 1.
Retornando à composição, litharge é o produto oxidado de chumbo derretido que foi agitado ou atomizado para incorporar ar, depois resfriado e moído para formar o pó amarelo.
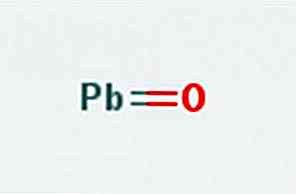
O nome masicotite é usado tanto para o mineral nativo como para o monóxido de chumbo produzido pelo aquecimento do carbonato de chumbo a 300ºC (monóxido de chumbo, 2016). Esses minerais são mostrados na figura 2.

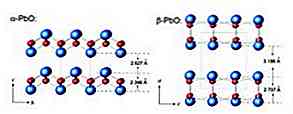
A masicotita tem uma estrutura ortorrômbica, enquanto a litrage tem uma estrutura cristalina tetragonal. O óxido de chumbo (II) tem a capacidade de alterar a estrutura quando aquecido ou resfriado. Essas estruturas são mostradas na Figura 3.
PbO é produzido por oxidação de chumbo metálico. O metal é derretido para fazer pastilhas de chumbo, e depois moído entre 170 e 210 ° C e passado através da chama para oxidação a temperaturas acima de 600 ℃. Os produtos de óxido são esmagados para obter o óxido de chumbo acabado (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
O PbO é produzido em larga escala como um produto intermediário no refino de minerais de chumbo em chumbo metálico. O mineral de chumbo utilizado é galena (sulfeto de chumbo (II)). A alta temperatura (1000 ° C) o enxofre é convertido no óxido da seguinte maneira:
2PbS + 3O2 → 2PbO + 2SO2
Índice
- 1 Propriedades físicas e químicas do óxido plumboso
- 2 Reatividade e riscos
- 3 usos
- 4 referências
Propriedades físicas e químicas do óxido plumboso
O monóxido de chumbo pode apresentar duas aparências diferentes: como pó seco amarelo com estrutura ortorrômbica (masicotita) ou como cristais tetragonais avermelhados (litário). Ambas as formas estão ilustradas na figura 4.

O composto tem um peso molecular de 223,20 g / mol e uma densidade de 9,53 g / ml. Tem um ponto de fusão de 888 ° C e um ponto de ebulição de 1470 ° C (National Center for Biotechnology Information, S.F.).
O composto não é muito solúvel em água, sendo capaz de dissolver apenas 0,0504 gramas para cada litro a 25 ° C na forma de masicotite e 0,1065 gramas para cada litro a 25 ° C na forma de litra. O composto também é insolúvel em álcool. É solúvel em ácido acético, HNO3 diluído e álcalis (Royal Society of Chemistry, 2015).
O composto é um agente oxidante ou redutor fraco, no entanto, as reações redox podem ainda ocorrer. Estes compostos não são reativos à água.
O óxido de chumbo oxida o carboneto de alumínio com incandescência quando aquecido. Misturas de óxido de chumbo com pó de alumínio (como com outros metais: sódio, zircônio) causam uma violenta explosão.
Reatividade e Perigos
O monóxido de chumbo é um composto classificado como venenoso. A substância é tóxica para o sistema nervoso central e pode ser carcinogênica em humanos (2013, 2013).
Os sintomas do envenenamento precoce são linhas de chumbo que aparecem na borda das gengivas e a pele se torna acinzentada. A síndrome neurastênica também surgirá no período inicial de envenenamento.
O envenenamento por cerebelo pode resultar em depressão por envenenamento por chumbo, mania por envenenamento por chumbo, bem como toxicidade por chumbo e sensibilidade à paralisia de múltiplas neurites.
O envenenamento por chumbo também pode causar anemia hipocrômica e distúrbios metabólicos e endócrinos. Além disso, o envenenamento por chumbo pode inibir a atividade de certas enzimas no sistema digestivo e causar indigestão, dor abdominal intensa e danos ao fígado. Também pode causar pressão alta e aumento do colesterol.
Se houver dor abdominal intensa, algumas medidas podem ser tomadas, tais como, injeção subcutânea de atropina e outras drogas, abdominal quente, enema, banho de água quente e assim por diante. A concentração máxima permitida no ar é de 0,01 mg / m3 (monóxido de chumbo, 2016).
Em caso de contacto com os olhos ou a pele, lave abundantemente com água. Em caso de inalação ou ingestão, a vítima deve ser levada para um local ventilado. O vômito não deve ser induzido. Se a vítima não respirar, a ressuscitação boca-a-boca deve ser administrada.
Em todos os casos, você deve procurar atendimento médico imediato. O monóxido de chumbo é um composto prejudicial ao meio ambiente, a bioacumulação deste produto químico pode ocorrer em plantas e mamíferos.
Recomenda-se vivamente que esta substância não entre no ambiente, pelo que deve ser manuseada e armazenada de acordo com as estipulações estabelecidas (Instituto Nacional de Segurança e Saúde Ocupacional, 2015).
Usos
O monóxido de chumbo tem sido usado como um secador de tinta e como um baixo fluxo de fogo na fabricação de cerâmica e vidro.O cristal de chumbo é utilizado no fabrico de utensílios de mesa de alta qualidade.
Usando o monóxido de chumbo como um fluxo, é possível obter um vidro com alto índice de refração e, consequentemente, o brilho desejado (Encyclopedia Britannica, 2016).
Condutores cerâmicos semi-metálicos têm as mais altas condutividades de todas as cerâmicas, exceto as supercondutoras. O óxido de chumbo é um exemplo deste tipo de cerâmica semi-metálica. Estes materiais têm sobrepostas bandas de energia de elétrons e são, portanto, excelentes condutores eletrônicos (Mason, 2008).
O óxido de chumbo é usado principalmente em tubos de elétrons, tubos de imagem, vidro óptico, vidro de chumbo anti-raios X e borrachas resistentes à radiação.
É usado como reagente analítico, o fluxo de silicato, mas também para a precipitação de aminoácidos
O óxido de chumbo é utilizado no fabrico de estabilizadores plásticos de PVC e é também a matéria-prima de outros sais de chumbo. Também é usado no refino de petróleo e para a determinação de ouro e prata.
Também é usado como pigmento amarelo em tintas e esmaltes. A masicotita foi usada como pigmento por artistas dos séculos XV a XVIII.
Camadas finas de monóxido de chumbo são usadas para produzir cores iridescentes em latão e bronze. Litharge mistura com glicerol para fazer cimento do encanador.
Referências
- Enciclopédia Britânica. (2016, 10 de outubro). Vidro. Recuperado da britannica: britannica.com.
- Kirk-Othmer. (1995). Enciclopédia de Tecnologia Química. 4ª ed. Volumes 1. Nova Iorque: John Wiley and Sons.
- Monóxido de chumbo. (2016, 1º de maio). Retirado de cameo.mfa: cameo.mfa.org.
- Monóxido de chumbo. (2016). Recuperado do chemicalbook: chemicalbook.com.
- Mason, T. O. (2008, 12 de março). Cerâmica condutiva. Recuperado da britannica: britannica.com.
- Ficha de Informações de Segurança de Material Óxido de chumbo, amarelo. (2013, 21 de maio). Obtido em sciencelab: sciencelab.com.
- Centro Nacional de Informações sobre Biotecnologia. (S.F.). Banco de Dados Composto PubChem; CID = 14827. Obtido em PubChem: pubchem.ncbi.nlm.nih.gov.
- Instituto Nacional de Segurança e Saúde Ocupacional. (2015, 22 de julho). LEAD (II) ÓXIDO. Retirado de cdc.gov: cdc.gov.
- Sociedade Real de Química. (2015). Óxido de chumbo (II). Retirado do chemspider: chemspider.com.


