Óxidos de Nitrogênio (NOx) Diferentes Formulações e Nomenclaturas
O óxidos de nitrogênio eles são essencialmente compostos inorgânicos gasosos que contêm ligações entre átomos de nitrogênio e oxigênio. Sua fórmula química de grupo é NOx, indicando que os óxidos têm diferentes proporções de oxigênio e nitrogênio.
O nitrogênio leva o grupo 15 da tabela periódica, enquanto o grupo oxigênio 16; ambos os elementos são membros do período 2. Essa proximidade é a razão pela qual as ligações N-O são covalentes nos óxidos. Desta forma, as ligações em óxidos de nitrogênio são covalentes.
Todos esses elos podem ser explicados usando a teoria do orbital molecular, que revela o paramagnetismo (um elétron desemparelhado no último orbital molecular) de alguns desses compostos. Destes, os compostos mais comuns são óxido nítrico e dióxido de nitrogênio.
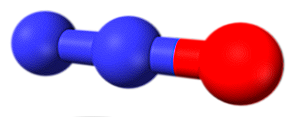
A molécula na imagem superior corresponde à estrutura angular da fase gasosa do dióxido de azoto (NO2). Em contraste, o óxido nítrico (NO) tem uma estrutura linear (considerando a hibridização sp para ambos os átomos).
Os óxidos de nitrogênio são gases produzidos por muitas atividades humanas, desde dirigir um veículo ou fumar cigarros, até processos industriais como lixo poluente. No entanto, o NO é naturalmente produzido por reações enzimáticas e raios em tempestades: N2(g) + O2(g) => 2NO (g)
As altas temperaturas dos raios quebram a barreira energética que impede que esta reação ocorra em condições normais. Qual barreira energética? Aquela formada pela ligação tripla N≡N, fazendo a molécula N2 um gás inerte da atmosfera.
Índice
- 1 Números de oxidação para nitrogênio e oxigênio em seus óxidos
- 2 diferentes formulações e nomenclaturas
- 2.1 Óxido nitroso (N2O)
- 2.2 Óxido Nítrico (NO)
- 2.3 trióxido de nitrogênio (N2O3)
- 2.4 dióxido e tetróxido de azoto (NO2, N2O4)
- 2,5 pentóxido de dinitrogênio (N2O5)
- 3 referências
Números de oxidação para nitrogênio e oxigênio em seus óxidos
A configuração eletrônica do oxigênio é [He] 2s22p4, precisando apenas de dois elétrons para completar o octeto de sua camada de valência; isto é, pode ganhar dois elétrons e ter um número de oxidação igual a -2.
Por outro lado, a configuração eletrônica do nitrogênio é [He] 2s22p3, sendo capaz de ganhar até três elétrons para preencher seu octeto de valência; por exemplo, no caso de amônia (NH3) tem um número de oxidação igual a -3. Mas o oxigênio é muito mais eletronegativo que o hidrogênio e "força" o nitrogênio a compartilhar seus elétrons.
Quantos elétrons o nitrogênio pode compartilhar com o oxigênio? Se você compartilhar os elétrons da sua camada de valência, um por um, atingirá o limite de cinco elétrons, correspondendo a um número de oxidação de +5.
Consequentemente, dependendo de quantas ligações se formam com o oxigênio, os números de oxidação do nitrogênio variam de +1 a +5.
Diferentes formulações e nomenclaturas
Os óxidos de nitrogênio, em ordem crescente dos números de oxidação do nitrogênio, são:
- N2Ou óxido nitroso (+1)
- NO, óxido nítrico (+2)
- N2O3trióxido de dinitrogênio (+3)
- NÃO2dióxido de azoto (+4)
- N2O5, pentóxido de dinitrogênio (+5)
Óxido nitroso (N2O)
Óxido nitroso (ou popularmente conhecido como gás do riso) é um gás incolor, com um leve cheiro doce e pouco reativo. Pode ser visualizado como uma molécula N2 (esferas azuis) que adicionou um átomo de oxigênio em uma extremidade. É preparado pela decomposição térmica de sais de nitrato e é usado como anestésico e analgésico.
O nitrogênio tem um número de oxidação de +1 neste óxido, o que significa que ele não é muito oxidado e sua demanda por elétrons não é convincente; no entanto, você só precisa ganhar dois elétrons (um para cada nitrogênio) para se tornar o nitrogênio molecular estável.
Em soluções básicas e ácidas, as reações são:
N2O (g) + 2H+(ac) + 2e- => N2(g) + H2O (l)
N2O (g) + H2O (l) + 2e- => N2(g) + 2OH-(ac)
Estas reações, embora termodinamicamente são favorecidas pela formação da molécula estável N2, eles ocorrem lentamente e os reagentes que doam o par de elétrons devem ser agentes redutores muito fortes.
Óxido Nítrico (NO)
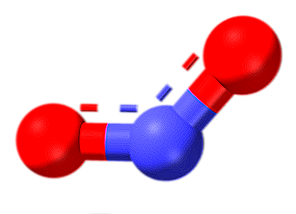
Este óxido consiste em um gás incolor, reativo e paramagnético. Como o óxido nitroso, ele tem uma estrutura molecular linear, mas com a grande diferença de que a ligação N = O também possui um caráter de ligação tripla.
NÃO rapidamente se oxida no ar para produzir NO2e, assim, gerar orbitais moleculares mais estáveis com um átomo de nitrogênio mais oxidado (+4).
2NO (g) + O2(g) => 2NO2g)
Estudos bioquímicos e fisiológicos estão por trás do papel benigno deste óxido nos organismos vivos.
Não é possível formar ligações N-N com uma outra molécula de NO devido à deslocalização do electrão não emparelhado no orbital molecular, que é dirigido para o átomo de oxigénio (para a sua elevada electronegatividade). O oposto ocorre com o NO2, que pode formar dímeros gasosos.
Trióxido de azoto (N2O3)
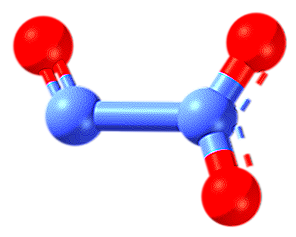
As linhas pontilhadas da estrutura indicam a ressonância da ligação dupla. Como todos os átomos, eles têm hibridização sp2, a molécula é plana e as interações moleculares são efetivas o suficiente para que o trióxido de nitrogênio exista como um sólido azul abaixo de -101ºC. Em temperaturas mais altas, ela se dissolve e se dissocia em NO e NO2.
Por que isso é dissociado? Como os números de oxidação +2 e +4 são mais estáveis que +3, o último presente no óxido para cada um dos dois átomos de nitrogênio. Isso, novamente, pode ser explicado pela estabilidade dos orbitais moleculares resultantes da desproporção.
Na imagem, o lado esquerdo do N2O3 corresponde ao NÃO, enquanto o lado direito ao NÃO2. Logicamente, é produzido pela coalescência dos óxidos anteriores a temperaturas muito frias (-20ºC). O N2O3 é anidrido de ácido nitroso (HNO2).
Dióxido e tetróxido de nitrogênio (NO2, N2O4)
Ele nao2 é um gás marrom ou marrom, reativo e paramagnético. Como tem um elétron desemparelhado, ele dimeriza (liga) com outra molécula gasosa do NO2 para formar o tetróxido de nitrogênio, gás incolor, estabelecendo um equilíbrio entre ambas as espécies químicas:
2NO2(g) <=> N2O4g)
É um agente oxidante venenoso e versátil, capaz de ser desproporcional em suas reações redox em íons (oxoanions).2- e não3- (gerando chuva ácida), ou no NO.
Da mesma forma, o NÃO2 está envolvido em reações atmosféricas complexas causando variações nas concentrações de ozônio (O3) em níveis terrestres e na estratosfera.
Pentóxido de dinitrogênio (N2O5)
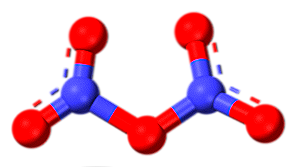 O pentóxido de dinitrogênio é um sólido cristalino, anidrido de ácido nítrico (HNO)3), e é a forma mais oxidada, portanto, mais oxidante do nitrogênio. Na fase gasosa tem uma estrutura molecular como ilustrado pela imagem, mas em uma fase sólida o óxido é composto de íons NO2+ e não3-.
O pentóxido de dinitrogênio é um sólido cristalino, anidrido de ácido nítrico (HNO)3), e é a forma mais oxidada, portanto, mais oxidante do nitrogênio. Na fase gasosa tem uma estrutura molecular como ilustrado pela imagem, mas em uma fase sólida o óxido é composto de íons NO2+ e não3-.
Quando hidratado gera HNO3e em altas concentrações do ácido o oxigênio é principalmente protonado com carga parcial positiva -O+-H, acelerando reações redox
Referências
- askIITians. ((2006-2018)). askIITians. Obtido em 29 de março de 2018, de askIITians: askiitians.com
- Encyclopaedia Britannica, Inc. (2018). Enciclopédia Britânica. Obtido em 29 de março de 2018, da Encyclopaedia Britannica: britannica.com
- Tox Town. (2017). Tox Town. Obtido em 29 de março de 2018, de Tox Town: toxtown.nlm.nih.gov
- Professora Patricia Shapley. (2010). Óxidos de nitrogênio na atmosfera. Universidade de Illinois. Retirado em 29 de março de 2018, de: butane.chem.uiuc.edu
- Arrepio e Atkins. (2008). Química Inorgânica Em Os elementos do grupo 15. (Quarta edição, pp. 361-366). Mc Graw Hill