Propriedades, estrutura, usos e riscos do iodoato de potássio
O iodato de potássio ou iodato de potássio é um composto inorgânico de iodo, especificamente um sal, cuja fórmula química é KIO3. O iodo, elemento do grupo dos halogênios (F, Cl, Br, I, As), possui neste sal um número de oxidação de +5; por isso, é um forte agente oxidante. O KIO3 dissocia-se em meio aquoso para criar os íons K+ e IO3-.
É sintetizado pela reação de hidróxido de potássio com ácido iódico: HIO3(aq) + KOH (s) => KIO3(aq) + H2O (l) Além disso, pode ser sintetizado pela reação de iodo molecular com hidróxido de potássio: 3I2(s) + 6KOH (s) => KIO3(aq) + 5KI (aq) + 3H2O (l)

Índice
- 1 Propriedades físicas e químicas
- 1.1 Agente oxidante
- 2 estrutura química
- 3 Usos e aplicações de iodato de potássio
- 3.1 Uso terapêutico
- 3.2 Uso na indústria
- 3.3 Uso analítico
- 3.4 Uso na tecnologia de lasers
- 4 Riscos para a saúde do iodato de potássio
- 5 referências
Propriedades físicas e químicas
É um sólido branco inodoro, com cristais finos e uma estrutura cristalina do tipo monoclínico. Tem uma densidade de 3,98 g / mL, um peso molecular de 214 g / mol e tem bandas de absorção no espectro do infravermelho (IR).
Possui um ponto de fusão: 833 ºK (560 ºC), consistente com as fortes interações iônicas entre os íons K+ e IO3-. Em temperaturas mais altas, sofre uma reação de decomposição térmica, liberando oxigênio molecular e iodeto de potássio:
2KIO3(s) => 2KI (s) + 3O2g)
Na água, possui solubilidades que variam de 4,74g / 100mL a 0ºC, até 32,3g / 100mL a 100ºC, gerando soluções aquosas incolores. Além disso, é insolúvel em álcool e ácido nítrico, mas é solúvel em ácido sulfúrico diluído.
Sua afinidade pela água não é apreciável, o que explica por que ela não é higroscópica e não existe na forma de sais hidratados (KIO)3· H2O)
Agente oxidante
O iodato de potássio, como indicado pela sua fórmula química, possui três átomos de oxigênio. Este é um elemento fortemente eletronegativo e, devido a essa propriedade, "descobre" uma deficiência eletrônica na nuvem que envolve o iodo.
Essa deficiência - ou contribuição, conforme o caso - pode ser calculada como o número de oxidação do iodo (± 1, +2, +3, +5, +7), sendo +5 para o caso deste sal.
O que significa isto? Que antes de uma espécie capaz de produzir seus elétrons, o iodo os aceita em sua forma iônica (IO3-) para se tornar iodo molecular e ter um número de oxidação igual a 0.
Seguindo esta explicação, pode ser determinado que o iodato de potássio é um composto oxidante que reage fortemente com agentes redutores em muitas reações redox; De todos estes, um é conhecido como o relógio de iodo.
O relógio de iodo consiste em um processo redox de passos lentos e rápidos, em que os passos rápidos são marcados por uma solução KIO3 em ácido sulfúrico ao qual é adicionado amido. Em seguida, o amido - uma vez produzido e ancorado entre as espécies de estrutura I3-- vai transformar a solução incolor para azul escuro.
IO3− + 3 HSO3− → eu− + 3 HSO4−
IO3− + 5 I− + 6 H+ → 3 I2 + 3 H2O
Eu2 + HSO3− + H2O → 2 I− + HSO4− + 2 H+ (azul escuro por efeito de amido)
Estrutura química
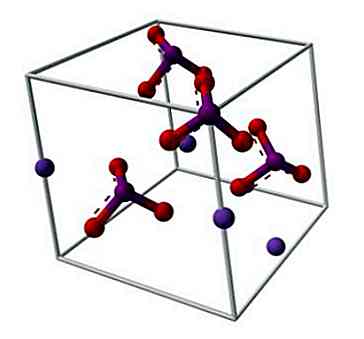
A estrutura química do iodato de potássio é ilustrada na imagem superior. O ânion IO3- é representado pelo "tripé" de esferas vermelhas e roxas, enquanto os íons K+ eles são representados pelas esferas roxas.
Mas o que esses tripés significam? As formas geométricas correcção destes aniões são realmente pirâmides trigonais, em que os átomos de oxigénio formam a base triangular, e o par não partilhado de pontos de electrões de iodo para cima, que ocupa espaço e forçando dobrar para baixo a ligação IO e os dois links I = O.
Esta geometria molecular corresponde a uma hibridação sp3 do omo central de iodo; entretanto, outra perspectiva sugere que um dos átomos de oxigênio forma ligações com os orbitais "d" do iodo, sendo de fato uma hibridação sp3d2 (o iodo pode ter seus orbitais "d" expandindo sua camada de valência).
Os cristais deste sal podem sofrer transições de fase estruturais (outros arranjos que não o monoclínico) como consequência das diferentes condições físicas que os sujeitam.
Usos e aplicações de iodato de potássio
Uso terapêutico
O iodato de potássio é geralmente usado para prevenir o acúmulo de radioatividade na tireóide na forma de 131Eu, quando este isótopo é usado na determinação da absorção de iodo pela tireóide como um componente do funcionamento da glândula tireóide.
Da mesma forma, o iodato de potássio é usado como um anti-séptico tópico (0,5%) nas infecções da mucosa.
Use na indústria
É adicionado à comida dos animais de criação como suplemento de iodo. Portanto, na indústria, o iodato de potássio é usado para melhorar a qualidade das farinhas.
Uso analítico
Em química analítica, graças à sua estabilidade, é utilizado como padrão primário na padronização de soluções padrão de tiossulfato de sódio (Na2S2O3), com a finalidade de determinar as concentrações de iodo nos problemas das amostras.
Isto significa que as quantidades de iodo podem ser conhecidas por técnicas volumétricas (titulações). Nesta reação, o iodato de potássio oxida rapidamente os iões iodeto I-, por meio da seguinte equação química:
IO3- + 5I- + 6H+ => 3I2 + 3H2O
Iodo, eu2, é intitulado com a solução de Na2S2O3 por sua padronização.
Uso na tecnologia de lasers
Estudos demonstraram e corroboraram as interessantes propriedades ferroelétricas, piezelétricas, piroelétricas, eletro-ópticas e na óptica não linear de cristais de KIO.3. Isso resulta em grande potencial no campo eletrônico e na tecnologia de lasers para materiais feitos com este composto.
Riscos para a saúde de iodato de potássio
Em doses elevadas pode causar irritação na mucosa oral, pele, olhos e trato respiratório.
Experimentos sobre a toxicidade do iodato de potássio em animais mostraram que, em cães em jejum, na dose de 0,2-0,25 g / kg de peso corporal, administrados por via oral, o composto causa vômitos.
Se esses vômitos são evitados, causa um agravamento da situação nos animais, uma vez que induz anorexia e prostração antes da morte. Suas autópsias permitiram observar lesões necróticas no fígado, rins e mucosa intestinal.
Devido ao seu poder oxidante, representa um risco de incêndio quando entra em contato com materiais inflamáveis.
Referências
- Dia, R. e Underwood, A. Química Analítica Quantitativa (quinta ed.) PEARSON Prentice Hall, p-364.
- Muth, D. (2008). Lasers [Figura]. Retirado de: flickr.com
- ChemicalBook. (2017). Iodato de potássio. Retirado em 25 de março de 2018, da ChemicalBook: chemicalbook.com
- PubChem. (2018) Iodato de potássio. Obtido em 25 de março de 2018, pela PubChem: pubchem.ncbi.nlm.nih.gov
- Merck (2018) Iodato de potássio. Recuperado em 25 de março de 2018, da Merck:
- merckmillipore.com
- Wikipédia. (2017). Iodato de potássio. Obtido em 25 de março de 2018, da Wikipedia: en.wikipedia.org
- M M Abdel Kader et al. (2013). Mecanismo de transporte de carga e transições de fase de baixa temperatura em KIO3. J. Phys.: Conf. Ser. 423 012036


