Estrutura, propriedades e usos do óxido de berílio (BeO)
O óxido de berílio (BeO) é um material cerâmico que, além de sua alta resistência e resistividade elétrica, possui alta capacidade de condução de calor que o faz parte de reatores nucleares, superando até os metais nesta última propriedade.
Além de sua utilidade como material sintético, ele também pode ser encontrado na natureza, embora seja raro. Sua gestão deve ser realizada com cuidado, pois tem a capacidade de prejudicar seriamente a saúde dos seres humanos.
No mundo moderno, observou-se como cientistas associados a empresas de tecnologia realizaram pesquisas para desenvolver materiais avançados para aplicações bastante especializadas, como aquelas que atendem materiais semicondutores e os da indústria aeroespacial.
O resultado disto foi a descoberta de substâncias que, graças às suas propriedades extremamente úteis e à sua alta durabilidade, nos deram a oportunidade de avançar no tempo, permitindo-nos levar a nossa tecnologia a níveis mais elevados.
Índice
- 1 estrutura química
- 2 Imóveis
- 2.1 Condutividade Elétrica
- 2.2 Condutividade Térmica
- 2.3 Propriedades Óticas
- 2.4 Riscos para a saúde
- 3 usos
- 3.1 Aplicações eletrônicas
- 3.2 Aplicações nucleares
- 3.3 Outras aplicações
- 4 referências
Estrutura química
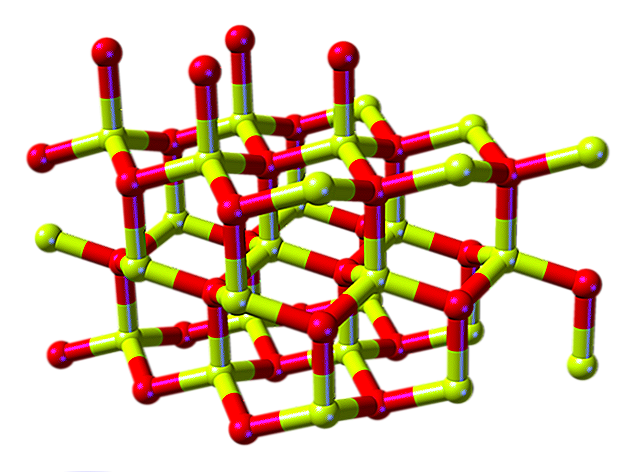
Uma molécula de óxido de berílio (também chamada "Berilia") é composto de um átomo de berílio e um átomo de oxigênio, ambos coordenados na orientação tetraédrica, e cristalizados em estruturas cristalinas hexagonais chamadas wurtzitas.
Estes cristais têm centros tetraédricos, que são ocupados por Be2+ e O2-. Em altas temperaturas, a estrutura do óxido de berílio torna-se tetragonal.
A obtenção do óxido de berílio é obtida por três métodos: a calcinação do carbonato de berílio, a desidratação do hidróxido de berílio ou a ignição do metal de berílio. O óxido de berílio formado em altas temperaturas é inerte, mas pode ser dissolvido por vários compostos.
BeCO3 + Calor → BeO + CO2 (Calcinação)
Seja (OH)2 → BeO + H2O (desidratação)
2 Be + O2 → 2 BeO (ignição)
Finalmente, o óxido de berílio pode ser vaporizado e, nesse estado, será apresentado na forma de moléculas diatômicas.
Propriedades
O óxido de berílio ocorre naturalmente como bromelita, um mineral branco encontrado em alguns depósitos complexos de ferro manganês, mas é mais comumente encontrado em sua forma sintética: um sólido branco amorfo que é produzido como um pó. .
Além disso, as impurezas que foram retidas durante a produção darão uma variedade de cores à amostra de óxido.
Seu ponto de fusão é 2507 ° C, seu ponto de ebulição é 3900 ° C, e tem uma densidade de 3,01 g / cm3.
Da mesma forma, sua estabilidade química é consideravelmente alta, apenas reagindo com o vapor de água a temperaturas próximas a 1000 ºC, e pode resistir a processos de redução de carbono e ataques por metais derretidos a altas temperaturas.
Além disso, sua resistência mecânica é decente e pode ser melhorada com projetos e fabricação adequados para usos comerciais.
Condutividade elétrica
O óxido de berílio é um material cerâmico muito estável e, portanto, tem uma resistividade elétrica razoavelmente alta que o torna um dos melhores materiais isolantes elétricos, junto com a alumina.
Devido a isso, este material é comumente usado para equipamentos elétricos especializados de alta freqüência.
Condutividade térmica
O óxido de berílio tem uma grande vantagem em termos de condutividade térmica: é conhecido como o segundo melhor material condutor de calor entre os não-metais, sendo superado apenas pelo diamante, um material consideravelmente mais caro e raro.
Quanto aos metais, apenas cobre e prata transferem melhor calor por condução do que o óxido de berílio, tornando-o um material muito desejável.
Devido às suas excelentes propriedades de condução de calor, esta substância tem estado envolvida na produção de materiais refratários.
Propriedades ópticas
Devido às suas propriedades cristalinas, o óxido de berílio é usado para a aplicação de material transparente ultravioleta em certas telas planas e células fotovoltaicas.
Da mesma forma, cristais de altíssima qualidade podem ser produzidos, de modo que essas propriedades melhoram de acordo com o processo de fabricação utilizado.
Riscos para a saúde
O óxido de berílio é um composto que deve ser manipulado com grande cuidado, uma vez que possui propriedades carcinogênicas, que têm sido associadas à inalação contínua de pós ou vapores deste material.
As pequenas partículas nestas fases do óxido aderem aos pulmões e podem gerar a formação de tumores ou uma doença conhecida como beriliose.
A beriliose é uma doença com uma taxa de mortalidade mediana que causa ineficiência na respiração, tosse, perda de peso e febre, e a formação de granulomas nos pulmões ou outros órgãos afetados.
Há também riscos à saúde pelo contato direto do óxido de berílio com a pele, pois é corrosivo e irritante e pode causar danos à superfície da pele e às membranas mucosas. O trato respiratório e as mãos devem ser protegidos quando se trabalha com este material, especialmente em sua forma de pó.
Usos
Os usos do óxido de berílio são divididos principalmente em três: aplicações eletrônicas, nucleares e outras.
Aplicações eletrônicas
A capacidade de transferir calor para um nível elevado e a sua boa resistividade elétrica fizeram com que o óxido de berílio adquirisse uma grande utilidade como dissipador de calor.
Seu uso tem sido evidenciado nos circuitos dentro de computadores de alta capacidade, além de equipamentos que lidam com altas correntes de eletricidade.
O óxido de berílio é transparente para raios X e microondas, por isso é usado em janelas contra esses tipos de radiação, bem como antenas, sistemas de comunicação e fornos de microondas.
Aplicações nucleares
Sua capacidade de moderar nêutrons e manter sua estrutura sob bombardeamento de radiação fez com que o óxido de berílio estivesse envolvido na construção de reatores nucleares, e também pode ser aplicado em reatores de alta temperatura refrigerados por gases.
Outras aplicações
A baixa densidade de óxido de berílio tem gerado interesse nas indústrias de tecnologia aeroespacial e militar, já que pode representar uma opção de baixo peso em motores de foguetes e coletes à prova de bala.
Finalmente, foi recentemente aplicado como material refratário na fusão de metais em indústrias metalúrgicas.
Referências
- PubChem. (s.f.) Óxido De Berílio. Obtido em pubchem.ncbi.nlm.nih.gov
- Reade. (s.f.) Berílio / óxido de berílio (BeO). Recuperado de reade.com
- Pesquisa, C. (s.f.). Óxido de berílio - berílio. Obtido de azom.com
- Serviços, N. J. (s.f.). Óxido De Berílio. Obtido por nj.gov
- Wikipédia. (s.f.) Óxido De Berílio. Obtido em en.wikipedia.org


