Fórmula de Óxido Cuprico, Propriedades, Riscos e Usos
O óxido cúprico, também chamado de óxido de cobre (II), é um composto químico de fórmula CuO. Sua estrutura é mostrada na Figura 1 (EMBL-EBI, 2017).
Óxido cúprico é encontrado na natureza como um dos componentes de minerais como tenorita e paramelaconita. É extraído de minerais em todo o mundo, principalmente na América do Sul, em países como Peru e Bolívia.
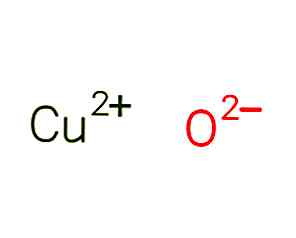
Alguns compostos químicos, como o carbonato de amônio e a amônia, são usados para promover a extração de minerais.

O óxido cúprico é produzido principalmente por extração em minerais, no entanto, há algum processo para produzi-lo industrialmente.
Nas indústrias, o óxido de cobre é preparado pela reação de ignição do nitrato cúprico tri-hidratado (100-20 ° C), hidróxido cúprico (100 ° C) ou carbonato de cobre (250 ° C):
2Cu (NÃO3)2 → 2CuO + 4NO2 + O2
Cu (OH)2(s) → CuO (s) + H2O (l)
Cuco3 → CuO + CO2
Também é preparado sinteticamente aquecendo o cobre metálico ao ar a cerca de 800 ° C (Fórmula de Óxido Cúprico, S.F.).
Propriedades físicas e químicas do óxido cúprico
Óxido de cobre (II) Aparece como um pó preto fino com uma estrutura iônica. Sua aparência é mostrada na figura 3.

A molécula é formada pelo cobre catiônico divalente Cu + 2 e o oxigênio aniônico O-2. As moléculas formam um sistema cristalino monoclínico, onde cada átomo de cobre é coordenado por 4 átomos de oxigênio.
Está intimamente relacionado com o outro óxido de cobre: Cu2O óxido cuproso (National Center for Biotechnology Information., 2005).
Seu peso molecular é de 79,545 g / mol e sua densidade é de 6,315 g / ml. Seu ponto de fusão é 1326 ° C, onde se decompõe liberando oxigênio, seu ponto de ebulição é acima de 2000 ° C.
O composto é insolúvel em água, álcool, hidróxido de amônio, carbonato de amônio e é solúvel em cloreto de amônio e cianeto de potássio (Royal Society of Chemistry, 2015).
O óxido de cobre é anfótero, podendo dissolver-se em ácidos e soluções alcalinas. Em solução alcalina, reage para formar outros sais de cobre:
2MetalOH + CuO + H2O → Metal2[Cu (OH)4]
Em soluções ácidas, também reage para formar outros sais de cobre:
CuO + 2HNO3 → Cu (NÃO3)2 + H2O
CuO + 2HCl → CuCl2 + H2O
Explode quando aquecido em contato com alumínio, hidrogênio ou magnésio. Além disso, quando aquecido, produz alguns vapores tóxicos.
Reatividade e Perigos
O óxido de cobre (II) é extremamente venenoso e tóxico por ingestão. Causa danos ao sistema nervoso central e ao sistema endócrino (AZoM, 2013).
Também é irritante para os olhos e a pele. É não-inflamável, estável e incompatível com agentes redutores, sulfeto de hidrogênio, alumínio, metais alcalinos, metais finamente pulverizados (Fisher scientiffic, 2009).
Em caso de contato com os olhos, você deve verificar se está usando lentes de contato e removê-las imediatamente.
Os olhos devem ser enxaguados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Você pode usar água fria. Unguento não deve ser usado para os olhos.
Se a substância entrar em contato com a roupa, remova-a o mais rápido possível, protegendo suas próprias mãos e corpo. Coloque a vítima sob um chuveiro de segurança.
Se a substância química se acumular na pele exposta da vítima, como as mãos, lave com cuidado e delicadeza a pele contaminada com água corrente e sabão não abrasivo.
Você pode usar água fria. Se a irritação persistir, procure um médico. Lave as roupas contaminadas antes de reutilizá-las.
Se o contacto com a pele for grave, deve ser lavado com um sabão desinfectante e cobrir a pele contaminada com um creme anti-bacteriano.
Em caso de inalação, a vítima deve poder descansar em uma área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível.
Afrouxe roupas apertadas, como gola de camisa, cintos ou gravata. Se a vítima achar difícil respirar, o oxigênio deve ser administrado.
Se a vítima não estiver respirando, uma ressuscitação boca-a-boca é realizada. Sempre levando em conta que pode ser perigoso para a pessoa que está fornecendo ajuda a ressuscitação boca-a-boca, quando o material inalado é tóxico, infeccioso ou corrosivo.
Em caso de ingestão, não induza o vômito. Afrouxe roupas apertadas, como camisas, cintos ou gravatas. Se a vítima não estiver respirando, realize uma ressuscitação boca-a-boca.
Em todos os casos, a atenção médica imediata deve ser solicitada (Cupric oxide, 2013).
Usos
Óxido cúprico é usado como um pigmento para cristais, esmaltes de porcelana e gemas artificiais. O óxido adiciona uma tonalidade azulada a esverdeada a esses materiais.
É também utilizado como agente dessulfurante para gases de petróleo e como catalisador de oxidação e eletrodos galvânicos (Encyclopædia Britannica, 2017).
O óxido cúprico é amplamente utilizado nas indústrias química e química agrícola para produzir produtos intermediários em alguns processos.
É um agente oxidante / redutor amplamente utilizado e um regulador do processo na reação química, especialmente na produção de petróleo.
O óxido cúprico é usado para produzir tintas e revestimentos e também é um ingrediente em alguns produtos de tratamento de ar.
Raramente utilizada como um suplemento dietético em animais, também tem aplicação como semicondutor do tipo p por causa do seu intervalo de banda estreita. É usado como uma alternativa para o óxido de ferro no cupim.
Através das suas propriedades fungicidas e microbicidas, óxido de cobre (II) também encontra utilização como um insecticida e fumigante.
É utilizado principalmente no tratamento de plantas de batata e como agente anti-incrustante em cascos de navios. Um agente anti-incrustante é um material que impede a formação de cracas e outros organismos no fundo de um navio.
Quando estes organismos crescem no casco de um barco, aumentar o atrito produzido quando o navio passa através da água, reduzindo assim a sua velocidade.
O composto também é usado como um conservante de madeira para proteger os postes de cercas, estacas, estrado, de coberturas, telhas, muros do mar e água doce e outras estruturas marinhas insectos e fungos (Thomson Gale, 2006).
Referências
- (2013, 21 de agosto). Semicondutores de Óxido de Cobre (II). Retirado de azom.com.
- Fórmula de Óxido Cúprico. (S.F.). Recuperado de softschools.com.
- EMBL-EBI (2017, 2 de fevereiro). óxido de cobre (II). Retirado de ChEBI.ac.uk.
- Enciclopédia Britânica. (2017, 16 de maio). Cobre (Cu). Recuperado de britannica.com.
- Fisher cientifico. (2009, 20 de setembro). Ficha de Informações de Segurança de Produto Óxido de cobre (II). Obtido em fke.uitm.edu.my.my.
- Ficha de Informações de Segurança de Produtos Químicos Cupric oxide. (2013, 21 de maio). Obtido em sciencelab.com.
- Centro Nacional de Informações sobre Biotecnologia ... (2005, 26 de março). Banco de Dados Composto PubChem; CID = 14829. Retirado do PubChem.
- Sociedade Real de Química. (2015). Óxido de cobre (II). Retirado de chemspider.com.
- Thomson Gale. (2006). Óxido De Cobre (II). Obtido em encyclopedia.com.


